Elektrochemische synthese van waterstofperoxide
Een groene manier om waterstofperoxide te maken
De wereldvraag naar waterstofperoxide was 4 miljoen ton in 2013, 5 miljoen ton in 2017 en wordt verwacht te stijgen tot 6 miljoen ton in 2024. Bijna de helft is voor de pulp-en-papierindustrie, maar een groeiend aandeel gaat naar de productie van propyleenoxide in het HPPO-proces. 5 grote producenten (Solvay, Evonik, Mitsubishi Gas Chemical Company, Arkema en Kemira) voorzien bijna 70% van de markt. Allen gebruiken het antrachinonproces, een omslachtig en milieuonvriendelijk proces met afvalproducten en een hoog energieverbruik. Een veilige en directe (elektrochemische) oxidatie van waterstof gloort aan de horizon.
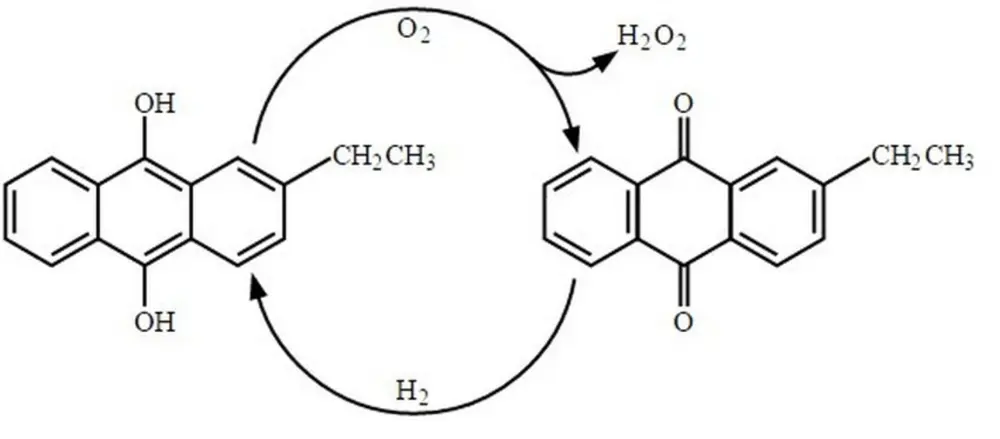
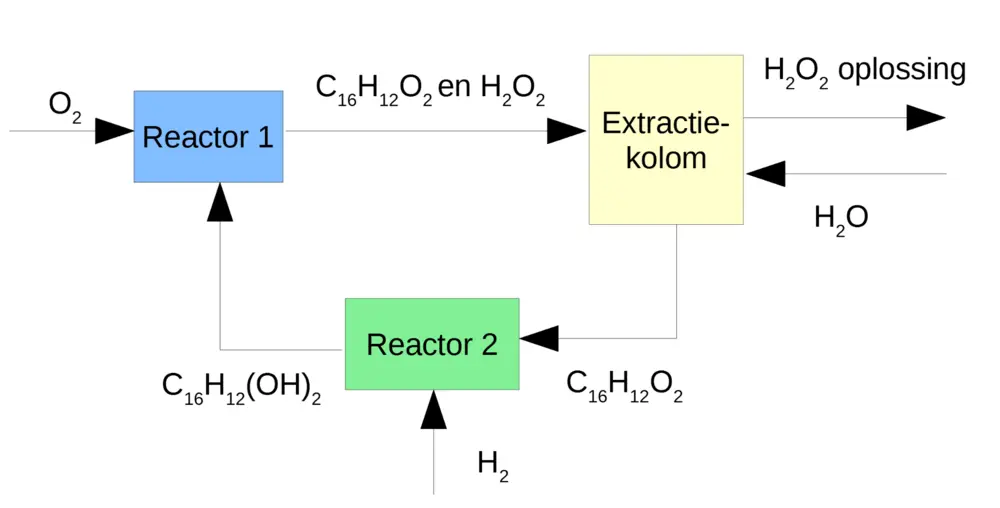
Het Antrachinonproces
Het antrachinonproces omvat 5-stappen:
1. Oxidatie: 2-ethylantrachinol (C16H12(OH)2) wordt in een oplosmiddel met zuurstof geoxideerd tot 2‑ethylantrachinon (C16H12O2 ) en waterstofperoxide.
2. Extractie: waterstofperoxide wordt met water uit het oplosmiddel geëxtraheerd.
3. Vacuümdestillatie van het peroxide.
4. Drogen van het oplosmiddel voor hergebruik.
5. Hydrogeneren van ethylantrachinon tot ethylantrachinol.
Directe synthese
Met een geschikte katalysator kunnen waterstof en zuurstof direct reageren tot waterstof peroxide in een slurry reactor, maar om veiligheidsredenen is dit proces nooit verder gekomen dan een enkele pilotinstallatie van DuPont, die ontplofte ondanks alle voorzorgen.

Elektrochemische synthese
In een elektrochemische cel blijven waterstof en zuurstof gescheiden door een membraan, waardoor het ontploffingsgevaar vermeden wordt. In feite komen er bij de eigenlijke synthese helemaal geen moleculaire waterstof en zuurstof meer aan te pas.
Verschillende configuraties zijn recentelijk voorgesteld. Eén hiervan is afkomstig van de Rice University in Houston [1]. Hierin worden waterstof en zuurstof eerst via een elektrochemische reactie omgezet tot ionen, voordat deze met elkaar reageren in een vast poreus elektrolyt. Dit levert een zuivere H2O2-oplossing in concentraties van 0,2 tot 20 gewichtsprocenten afhankelijk van de snelheid van het water dat door de elektrolyt stroomt.
Werkingsprincipe
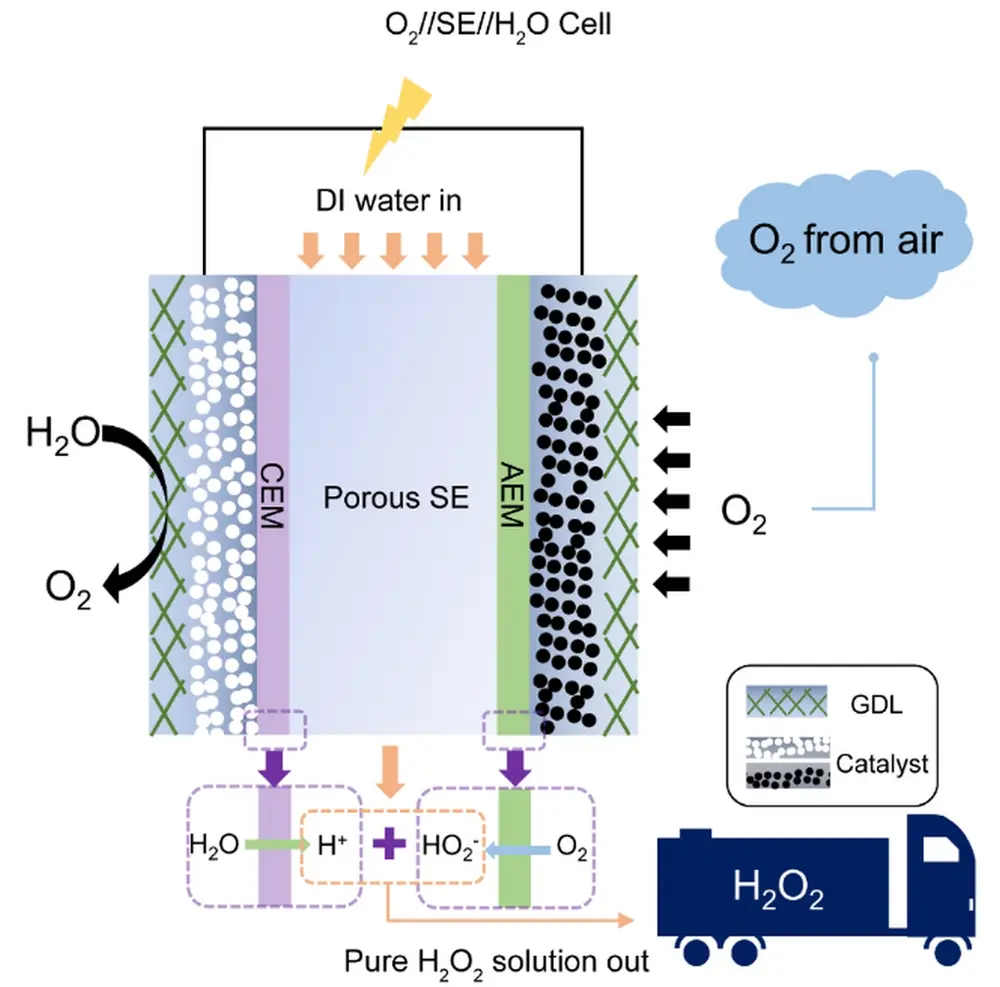
In Figuur 4 is de elektrochemische cel schematisch afgebeeld, waarbij is te zien dat waterstof (links) en zuurstof (rechts) eerst door een gasdiffusielaag stromen.
Daarachter bevindt zich een katalysator waarop twee elektrochemische halfreacties plaatsvinden:
• voor waterstof vindt deze plaats in de laag met witte balletjes via de waterstof-oxidatiereactie (HOR) volgens de reactie:
H2 → 2 H+ + 2e-
• voor zuurstof in de laag met zwarte balletjes via de twee elektron zuurstofreductiereactie (2e–ORR) volgens reactie:
2e- + H+ + O2 → HO2-
De paarse laag verder in het midden van Figuur 4 van de HOR-reactie is een proton exchange membraan die protonen (H+) transporteert naar het centrum. De groene laag van de (2e-ORR)-reactie is een kation exchange membraan die HO2--ionen transporteert naar het centrum. In het centrum van het systeem is er dan een laag met een vast poreus elektrolyt waardoorheen water loopt. Hierin vindt de volgende reactie plaats:
H+ + HO2- → H2O2
Het water verdunt het waterstofperoxide en voert het af. Een hogere stroomsnelheid geeft een lagere waterstofperoxideconcentratie dan wanneer het langzamer stroomt. Bovendien is de waterstofperoxideconcentratie afhankelijk van de hoeveelheid HO2--ionen die wordt geproduceerd en die is onder andere afhankelijk van de zuurstofconcentratie.
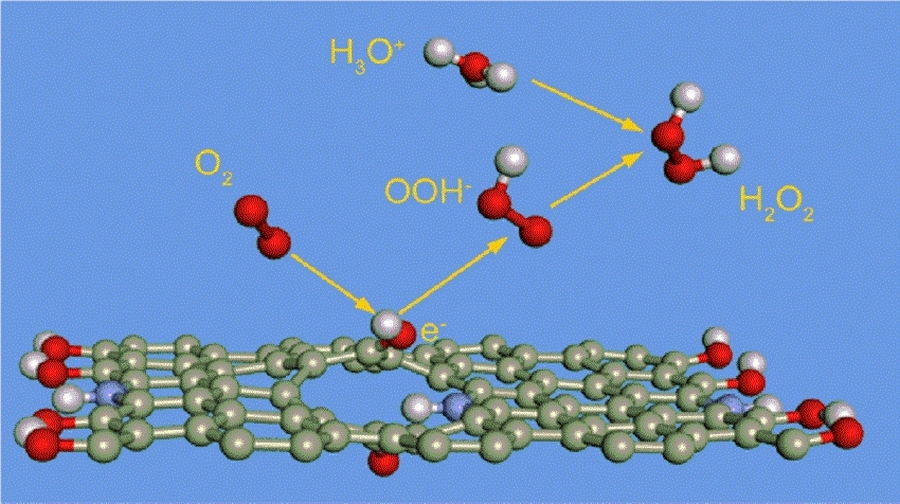
De katalysatoren van de elektrochemische halfreacties
De katalysator voor de waterstof-oxidatiereactie (HOR) is platina op koolstof. Voor de twee elektron zuurstofreductiereactie (2e-ORR) is in de literatuur geen goede katalysator bekend (voor de vier elektron zuurstofreductiereactie (4e-ORR) naar water wel).
Wang en collega's [1] hebben hiervoor een nieuwe katalysator ontwikkeld, gebaseerd op carbon black. Na behandeling met salpeterzuur kreeg dit nano-materiaal functionaliteiten als ethers, alcoholen en carbonzuren. Deze functionaliteiten leveren de protonen die nodig zijn voor de twee elektron zuurstofreductiereactie (zie Figuur 5).
De onderzoekers hebben het systeem geoptimaliseerd en vonden daarbij dat het zuurstofgehalte het beste 10% kan zijn. Hierbij was de H2O2-omzetting ongeveer 98% bij een stroomsterkte van ongeveer 300 A/cm².
Een voordeel van dit systeem met 2e-ORR is dat het naast waterstofperoxide ook nog stroom levert, net als een brandstofcel die water levert (4e-ORR) en wel theoretisch de helft. Het ontworpen systeem is waarschijnlijk ook voor andere vloeistoffen te gebruiken.
Er is een goede reden aan te nemen dat in de toekomst de twee elektron zuurstofreductiereactie naar waterstofperoxide in plaats van de traditionele vier elektron zuurstofreductiereactie naar water een steeds belangrijkere groene methode zal worden om waterstofperoxide te maken. Het opent de weg naar kleinschalige on-siteproductie waardoor vervoer van grote hoeveelheden hoog geconcentreerde peroxide voorkomen kan worden. Door de productiesnelheid en concentratie aan te passen aan de behoefte wordt niet alleen de veiligheid verhoogd, maar ook de efficiency van het down-streamproces.
Referenties
[1] Haotian Wang et. al., Direct electrosynthesis of pure aqueous H2O2-solutions up to 20 % weight using a solid electrolyte, Science, 11 oct. 2019, vol 366, issue 6462, pp 226-331
[2] Daniel Linzel, Makkelijke waterstofperoxideproductie, C2W, november 2019, pag. 6
